两篇Nature提出癌症干细胞概念新质疑:干细胞与癌症转移
文章内容转自生物探索
科学家们认为干细胞分裂是肿瘤生长所必需的,癌症干细胞能驱动肿瘤生长与转移,由此提出了将去除癌症干细胞作为癌症治疗的靶标之一。然而这在许多类型的癌症中都还没有找到确凿的实验证据。最新一期(3月29日)Nature杂志中,来自日本和美国的科学家通过靶向去除特殊的干细胞群体,发现了这些干细胞在肿瘤发展中的作用,以及对于癌症转移的影响。
Lgr5+干细胞
小肠上皮细胞层是哺乳动物机体的自我更新支持者,它的生命周期只有4-5天。结合其特征性的隐窝-绒毛结构,这一上皮细胞成为了研究哺乳动物干细胞的选择模型。肠隐窝两种干细胞群(一种快速循环,一种静止)的功能及相互关系一直是引起注意且存在争议的一个重要问题。
隐窝底的干细胞形成年轻上皮细胞后,在分化及离开隐窝前2天,这些上皮细胞会频繁增殖。细胞随后移动到绒毛侧面处理营养物,最终在4-5天内在绒毛顶端死亡。同样来源于干细胞的潘氏细胞(Paneth cell)却能在隐窝底存留1-2个月,被认为在那里维持了干细胞更新,及保护对抗细菌。
十多年前,科学家们定义了隐窝干细胞两种选择性的身份。一方面,有人认为,挤在潘氏细胞之间的小增殖细胞是隐窝干细胞。后来,蛋白质Lgr5被确定为是这些细胞的一种灵敏标记物,提供了它们体内“干性”( stemness)的证据。随后,单一表达Lgr5(Lgr5+)的细胞被证实在体外形成了不断扩大的、可移植的“微型肠”。另一方面,研究人员在潘氏细胞上方+4位点直接标记出了DNA标记滞留细胞(LRCs)。随后他们报道了静态“+4 LRCs”的一些分子标记物,其中包括Bmi1蛋白。
令人惊讶的研究结果
在最新研究中,Genentech公司的Frederic J. de Sauvage等人发现在结肠癌中,原发性肿瘤细胞生长并不需要Lgr5+肿瘤干细胞,这是因为后者具有可塑性。研究人员去除了Lgr5+干细胞之后,并没有观察到预期中的退化现象。相反,Lgr5-细胞维持了肿瘤生长。但是研究人员也发现肿瘤细胞在肝脏中的转移扩散和生长受到了很大限制,这表明Lgr5+肿瘤干细胞对这一过程是不可或缺的,因此或许可以成为应对癌症转移的一个靶点。
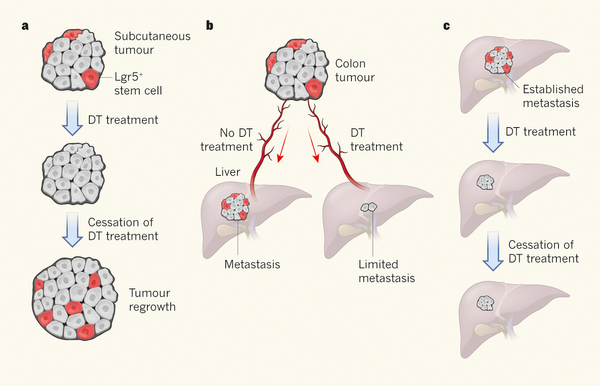
Sauvage研究组此前构建了能在Lgr5+干细胞中表达白喉毒素受体的转基因小鼠,同时也加入了一个能用于显微观察细胞的荧光蛋白。当让这些动物接触白喉毒素时,就会特异性破坏Lgr5+细胞。由此利用来自这些小鼠的细胞,研究人员建立了称为的体外肠细胞群,并利用基因组编辑技术,将大肠癌发展过程中所需的几种突变引入到了细胞里。
研究人员将带有突变的到了小鼠中,这样细胞形成肿瘤,在用白喉毒素处理后,这些小鼠中Lgr5+细胞长期被剔除了。然而他们发现Lgr5+细胞的破坏并没有使肿瘤缩小,肿瘤依然保持着之前的大小。这表明一些非Lgr5表达细胞可能可以补偿Lgr5 +细胞的损失,来维持肿瘤大小。
此外,当研究人员停止使用白喉毒素,Lgr5+细胞迅速再次出现,肿瘤生长速度与未用白喉毒素治疗的对照肿瘤移植中中立的生长速度并没有出现多少差别(见下图)。与对照相比,来自Lgr5+剔除后肿瘤的癌细胞出现了Myc下游靶标的增加(Myc是一种可以驱动细胞周期进程的蛋白质),而这可能是由于Lgr5 +细胞缺失情况下,癌细胞的代偿性生长。
研究证明,Lgr5+细胞并不是肿瘤维持所必要的,这一结果无疑令人感到惊讶。不过研究也表明这能增加肠道中细胞可塑性,也就是细胞从一种类型转变为另一种类型的能力,在肠道中,是指在再生,以及肿瘤起始阶段,通过去分化从肠上皮细胞逆转变成干细胞的能力。
研究表明干性(具有能够自我更新和分化的干细胞特性)是癌转移的先决条件,癌转移一般认为是肿瘤细胞从肿瘤形成的主要部位迁移到远处的肿瘤的过程。
在这项研究中,当研究人员将肿瘤形成的组织细胞移植到小鼠结肠中时,发现发生了转移,并在肝脏中形成肿瘤。然而如果用白喉毒素治疗小鼠,转移性肝肿瘤显著减少,这表明Lgr5+细胞参与了癌转移。而且更加令人惊讶的是,研究人员发现已出现肝转移的细胞,如果缺失Lgr5+细胞,就会导致这些肿瘤收缩,当停止白喉毒素治疗时,这些转移也没有再次开始生长。
这些研究结果引发了对一种癌症干细胞模型的质疑,单向层次模型,生物通译)。干细胞通常被认为仅占细胞群体的一小部分,然而,考虑到在研究中发现的肿瘤Lgr5 +细胞数量相对较高,因此可能有另外一种解释:结肠癌Lgr5+细胞不具有相同的干细胞特征,因为它用于支持组织平衡。
但是,鉴于之前的细胞谱系跟踪实验(证实了Lgr5+细胞的干细胞特性),并且肿瘤也能快速补充丢失的Lgr5+细胞,因此存在另外一种类型干细胞参与了癌症和体内平衡的可能性并不大。也许缺乏专门的干细胞群体可能是一个更合理的解释,这也支持之前的一个观点:干性应该是细胞细胞生命期中任何时间可以获得的属性,与它的分化状态无关。
另外一项研究提出的新问题
日本庆应义塾大学的研究人员也发表论文,指出在人结肠癌中,LGR5+细胞的选择性破坏会导致暂时肿瘤的消退,其它细胞则会出现补偿性增殖。因此,必须确定负责Lgr5+细胞再出现的信号通路。Genentech的研究结果初步指出了Myc信号传递的作用,但是Lgr5+细胞丢失如何被肿瘤中的剩余细胞所发现,以及在缺失Lgr5+细胞时,哪些信号级联也许会导致Myc激活,还并不清楚。此外,研究并没有检测Myc的抑制或丢失是否会阻止储备干细胞池的运作,也没有检测Myc抑制是否可以在没有Lgr5+细胞的情况下引起原发性肿瘤的消退。
目前,Myc药理学抑制研究存在许多挑战,因此鉴定其上游信号通路或其它必需途径可能具有重要意义,研究指出剔除Lgr5 +细胞可能是一种针对肝转移值得尝试的新方法,未来也许会给我们带来好消息。
- 上一篇:Science:不同的面孔是怎样形成的? 2017/4/1
- 下一篇:Cell对话:我们该如何应用基因编辑? 2017/4/1

